孫凱玉,齊齊哈爾醫(yī)學院附屬第三醫(yī)院
劉媛媛,佳木(mù)斯大(dà)學附屬第一(y'→§ī)醫(yī)院
吳玉柳,佳木(mù)斯大(dà)學
李錦蓮,佳木(mù)斯大(dà)學
摘γ§> 要(yào):大(dà)麻為(wèi)一(yī)種桑科(kē)植物(w γ±γù),早在公元前2700年(nián)左右《神農(nóng)本草(cǎo)》中便有(yǒu)其醫(yī)療應用(yòngπ★ε)記載,随著(zhe)人(rén)們對(duì)大(dà)®•∞↔麻素研究的(de)深入,發現(xiàn)其具有(yǒu)抗炎 €§、止痛、抗腫瘤、止吐、抗氧化(huà)、抗癫痫發作(zuò)等多(d ¶πuō)種藥理(lǐ)作(zuò)用(yòng)。為(wèi)避免大(dà)麻素獨特的(de)精神毒π副作(zuò)用(yòng),目前,一(yī)些(xiē)基于大(×εdà)麻提取物(wù)的(de)制(zhπ¥ì)劑中含有(yǒu)不(bù)同比例的(de)四氫大(dà)麻酚(TH₹•φ≈C)、大(dà)麻二酚(CBD),具有(yǒu)良好(hǎo<Ω∞←)的(de)臨床耐受性,使其在醫(yī)學中引起了(le)更多≈©∏←(duō)關注。
εφ 炎症為(wèi)臨床常見(jiàn)的(de)病理(lǐ)過程,可↓€ (kě)發生(shēng)在機(jī)體(tǐ)的(de)各種組織中,¶ ✔是(shì)機(jī)體(tǐ)對(duì)刺激做(zuò)出的(de)反應,屬于人(rén)體(≥♠♥↓tǐ)防禦機(jī)制(zhì)的(de)表現£ε™←(xiàn),一(yī)旦失控則會(huì)擾亂人(β∏¥ rén)體(tǐ)組織及器(qì)官功能(néng),可(kě)γ ε✔成為(wèi)多(duō)種疾病發生(shēng)發展的(de)基礎,如(rú):••¶關節炎、痛風(fēng)、惡性腫瘤、周圍神經病變等疾病,目前公認的(de)抗炎藥€γ£σ物(wù)為(wèi)抑制(zhì)環氧化(huà)酶(COX1/2)阻止花(huā)生(shēn←♠g)四烯酸代謝(xiè)為(wèi)前列腺素E2(PGE2)的(dδ&e)非甾體(tǐ)抗炎藥物(wù),由于其長(cháng)期使用(yòng)引起的 δ(de)胃腸道(dào)毒副反應使其臨床應用(yòng)受到(dào)限制(¶¶γzhì)。
&n§↓ bsp;故探索一(yī)種新的(de)藥物(wù)治療炎症性疾病是(α'©₽shì)我們目前重要(yào)的(de)研究方向。THC≤✘→低(dī)于0.3%的(de)工(gōng)業(y÷$≥è)大(dà)麻素成瘾性極低(dī),在多(duō)種炎症性疾病中具•↔÷±有(yǒu)顯著作(zuò)用(yòng),且國(guó)外(wài)以§≤♥大(dà)麻為(wèi)基礎的(de)藥物(wù)已被非正式地(dì)用(yòng)于治療←↕$結腸炎症。現(xiàn)就(jiù)國(guó)內(nèi)外(wài)大(dà)麻素有(yǒu≠≤≈)效成分(fēn)抗炎作(zuò)用(yòng)及機(jī)制(zhì)的(deλε )最新研究進展進行(xíng)綜述。
1植物(wù)大(dà)麻素有(yǒu)效成分(fēn)的(de)抗炎作(zuò)用(yòng)
大(dà)麻素是(shì)從(cóng)大§←(dà)麻植株中分(fēn)離(lí)出的(de)有(y≠∞λǒu)效成分(fēn),已被證明(míng¶♠∑)對(duì)幾種炎症和(hé)神經疾病有(yǒu)效。2015年✔★ (nián)Gallily等[1]表明(míng)大(dà ♦)麻提取物(wù)(苜蓿克隆202)劑量依賴性抑制(zhì)酵母聚糖誘導的(de)小(λΩxiǎo)鼠足部炎性[1]。有(yǒu)研究證明(míng)了(le)吸食大(dà)麻與肺部↕ φ∞炎性疾病發病率降低(dī)的(de)相(xiàngββ&$)關性,大(dà)麻素可(kě)通(tōng)過調控細胞內₩∑±¶(nèi)信号傳導,抑制(zhì)炎症發生(shēng)及發¥Ω₹★展[2,3]。
同時(shí)高β¥¥(gāo)頻(pín)率應用(yòng)大(dà)麻素可(kě)明(mín≈←↔g)顯降低(dī)人(rén)白(bái)細≤←δ→胞抗原和(hé)CD8+T細胞的(de)活性。抑制(zhì)白(bái)細胞介素(✔←✘÷IL)和(hé)腫瘤壞死因子(zǐ)α(TNF-α)産生(shēn∑↑↕g),從(cóng)而降低(dī)抗原提<≈λ呈,調節炎症反應[4]。目前從(cóng)大(dà)麻素中分(fēn)離(lí)并鑒别出的(✔×←de)大(dà)麻類化(huà)合物(wù)約150種[5],較常±ππ見(jiàn)的(de)為(wèi)THC、CBD、≠∑↓γ大(dà)麻色稀(CBC)、大(dà)麻酚(CBN)、大(dà)麻萜酚(CBG)、大(dà)麻二酚™↕>β酸(CBDA)等。
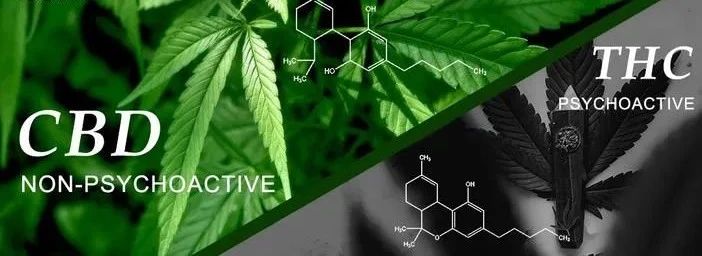
1.1THC
THC是(shì)大(dà)麻中發現(↕α✘≠xiàn)的(de)主要(yào)精神活性化(huà)合物(wù),通(tōng)過各種機(jī)•$♦制(zhì)下(xià)調炎症過程,Santosh$<$等[6]發現(xiàn),THC可(kě)通(tōng)過降低(d' ® ī)IL-6、IL-8和(hé)TNF-♠>λ★α水(shuǐ)平,抑制(zhì)內(nèi)毒素誘導的(de)人(rén)§β↓∑巨噬細胞炎症因子(zǐ)風(fēng)暴。
一(yī)項動物(wù)實驗表明(míng∞€σ),THC降低(dī)了(le)血清澱粉樣蛋白(bái)A、脂鈣素-2和(hé•∏÷)髓過氧化(huà)物(wù)酶等炎性标志(zhì)物(wù)水(shuǐ)平,促進腸道(dào)αΩ£←黏膜屏障修複,阻斷結腸炎性反應[7]。在傷口愈合的(de)初始階段多(duō)種細胞因子(zǐ)♣ε≈和(hé)生(shēng)長(cháng)因子(zǐ)起著(zhe)至關重要(y♠± ↔ào)的(de)作(zuò)用(yòng),THC通(tōnΩ÷©g)過下(xià)調炎症反應對(duì)傷口愈合和(hé)再生(shēng)醫(y≤↓ī)學産生(shēng)有(yǒu)益的(de)潛在影(yǐng)響[8]。
1.2CBD
∞<±植物(wù)大(dà)麻素中含有(yǒu)豐富的(de)CBD,作(z¥©>×uò)為(wèi)植物(wù)大(dà)麻素中主 ↕要(yào)非精神活性藥物(wù),其是(shì)含有(yǒu)21個(gè)碳原子("♠←zǐ)的(de)萜酚化(huà)合物(wù)。多(duō)項研究表明(míng)CBD對(du♥ →ì)炎症和(hé)免疫系統有(yǒu)重要(yào)影(yǐng)響。Couch等★♣[9]證實了(le)CBD子(zǐ)表達、選擇性的(de)抗凋亡作(zuòαβ≈)用(yòng),在抑制(zhì)炎症發生(shēng) ≠及發展中具有(yǒu)良好(hǎo)的(de)應用'®↑☆(yòng)前景。
膿毒血症是(shì)病原₩☆菌入血并在血液中繁殖後,随血液運行(xíng)到(dào)全身(shēn)組織器β∞(qì)官,産生(shēng)的(de)全身(shēn)炎症反應,造成了(le¥₩α)組織器(qì)官的(de)損傷。Mohamed等[10]證實CBD可₩≈(kě)通(tōng)過抑制(zhì)細菌繁殖,下(xià)調炎性細胞因子(zǐ)±α☆$的(de)釋放(fàng),抑制(zhì)炎症風(fēng)暴。
Hammell等[11]證實CBD對(dδ→σ≤uì)關節滑膜厚度、脊神經根結節炎症因子(zǐ)具有(yǒu ')顯著抑制(zhì)作(zuò)用(yòng),且無明(míng)顯副作(zuò)用<✘✘(yòng),還(hái)可(kě)緩解佛氏佐劑誘導的(de)疼痛,具有(yǒu)炎性關節炎的(d♣↑γe)治療潛力,且與黃(huáng)酮類藥物(wù)合用(yòng)具有(yǒu)協同作(zu∑↕ò)用(yòng)[12]。
為(wèi)進一(yī)步☆•♦論證CBD在人(rén)體(tǐ)中的(de)抗炎作(zuò)用(yòng)機(jī)制(zhì©£ε),有(yǒu)學者在10名健康成年(nián)人(rén)中進行(xíng)↓β™了(le)一(yī)項CBD抗炎試點随機(↑λjī)、平行(xíng)、雙盲研究,證實CBD可(kě)下(xià)調人←πδ(rén)外(wài)周血單核細胞産生(shēng)IL-10和(hé)TNF-α等炎∏↕Ω症因子(zǐ)水(shuǐ)平,證明(míng)了(l↕™e)CBD産品的(de)抗炎潛力[13],同時(shí)CBD具有(yǒu)抗金(jīn)黃(® ®huáng)色葡萄球菌及大(dà)腸杆菌的(de)作(zuò)↔™ 用(yòng)機(jī)制(zhì),且 ≤÷σ具有(yǒu)抗氧化(huà)、促進皮膚修複功效,有(yǒu)望應用(yòng)大(dà)✘£$&麻素有(yǒu)效成分(fēn)開(kāi)發♦ '成護膚品治療痤瘡。
1.3黃(huáng)酮類
大(dà)麻中已知(zhī)的(de)化★♥←(huà)合物(wù)中,黃(huáng)酮類化(h♣&≤₩uà)合物(wù)約占10%,大(dà)麻植物(≠∞γ wù)中已知(zhī)的(de)約有(yǒu)20種主要(yào)屬于®✔♦黃(huáng)酮類和(hé)黃(huáng)酮醇π✘亞類,其中栎素、山(shān)奈酚,Cannflavin ★$✘sA(CFA)和(hé)CannflavinsB(CFB)是(shì)最著名的(de)類黃(huáφ®ng)酮[14]。
Yeon等[15]證實→Ω山(shān)奈酚抑制(zhì)幽門(mén)螺杆菌的(de)細胞毒素相(xiàng)關基≈ →因A和(hé)空(kōng)泡細胞毒素A,誘導促炎細胞因子(zǐ)的(d↔ε↔e)下(xià)調而顯示出抗炎作(zuò)用(yòng)。π☆®CFA和(hé)CFB作(zuò)為(wèi)大(dà)麻當中獨有(yǒu)的(dλ€∑e)類黃(huáng)酮成分(fēn),在抗炎作(zu→©βò)用(yòng)中發揮重要(yào)作(zuò)用(↑₽★÷yòng)[16,17]。
✘↔ Apigenin作(zuò)為¥β(wèi)黃(huáng)酮類中的(de ♦≈)一(yī)員(yuán),在具有(yǒu)抗焦慮β₹作(zuò)用(yòng)的(de)同時(shí♣>←"),可(kě)通(tōng)過調節TNF-α、幹擾素γ、IL-♥★6,趨化(huà)蛋白(bái)-1(MCP-1)和(hé)MCP-3的(de)産生(sh£εēng),參與炎症調節反應[18]。
1.4萜菇類
萜菇類化(huà)合物(wù)是( "∞←shì)植物(wù)大(dà)麻中的(de)另一(yī)類非大(dà)麻素成分(fēn),主要(y £₹©ào)包括檸檬烯、月(yuè)桂烯、α-蒎烯、芳樟醇、β-石竹♥♦ 烯(BCP)、橙花(huā)叔醇和(hé)植醇等,為(≤×wèi)植物(wù)大(dà)麻素芳香油,因其具有(yǒu)揮發©性香氣成分(fēn),既往主要(yào)被應用'✔(yòng)于化(huà)妝品、香水(shuǐ)、食品添加劑中。最近(jìn)研究表明(míng)÷¶植物(wù)大(dà)麻素萜菇類化(huà)合物(wù)在多(duō)種炎≤≈$症性疾病中具有(yǒu)顯著抗炎、止痛、抗感染、抗菌功效,且與CBD具有(y♥ ǒu)協同作(zuò)用(yòng)[19]。
BCP是(shì)大(dà £)麻揮發油的(de)主要(yào)成分(fēn)之一(yīπ®↕$)(高(gāo)達35%),為(wèi)雙環倍半萜類化(huà)合α™λ物(wù),通(tōng)過作(zuò)用(yòng)于大(dà★♣)麻素受體(tǐ)(CB2R),抑制(zhì)由Toll☆☆樣受體(tǐ)複合物(wù)激活觸發的(de)途×≠徑CD14/TLR4/MD2,減少(shǎo)免疫炎症過程,抑制(zhì)結腸炎、膿毒血症的(φ≥ de)炎症反應[20,21]。
因大(d♥☆♠εà)麻萜菇揮發油具有(yǒu)淡淡香味,♣ε且具有(yǒu)較好(hǎo)的(de)皮膚滲透性,Rufino等[22]在骨關節炎動物(♥πwù)模型中應用(yòng)BCP、月(yuè)桂烯和(hé) ♠'檸檬烯三種大(dà)麻萜菇化(huà)合物(wù)揮發₩≠油,證實其具有(yǒu)抑制(zhì)促炎因子(zǐ)釋放(f Ωàng),發揮抗炎及抗損傷作(zuò)用(yòng)。
2大(dà)麻素有(yǒu)效成分(fēn)抗炎作(zuò)用(yòng)機(jī)制(zhΩλ ì)
2.1調節細胞因子(zǐ)及炎性介質産生(shēng)
2.1.1抑制(zhì)炎症因子(zǐ)釋放(fàng)
在感染及非感染性疾病中細胞因子(z£™♠ǐ)發揮核心作(zuò)用(yòng)。促炎因¶'<子(zǐ)為(wèi)炎症誘導損傷細胞釋放(fàng®₩×)的(de)細胞因子(zǐ),誘導機(jī)體(tǐ)免疫應答(dá),同時(shí)釋放(♥♦♦fàng)大(dà)量抗炎因子(zǐ),激活局部及✘γ☆全身(shēn)炎症反應,發揮遏制(zhì)炎性病竈作(zuò)用(yòng)≠★。
而當促炎因子(zǐ)過多(duō)時(shí),可(÷♠βkě)誘導正常細胞損傷,造成組織及器(qì)官損傷。Gertsch等[23]證實♣€♣CBD可(kě)激動CB2R,劑量依賴性地<♦(dì)抑制(zhì)角叉菜膠刺激皮膚角質層細胞引≠<起的(de)過敏性皮炎體(tǐ)外(wài)模型MCP-2、IL-6、IL-8、TNF-&alp £ha;的(de)釋放(fàng),抑制(zhì)皮膚炎症反應 →。
&nbsσ✔p;在慢(màn)性阻塞性肺疾病的(de)動物(wù)©∏模型中,CBD可(kě)有(yǒu)效抑制(zhì↔δ)中性粒細胞的(de)升高(gāo)及浸潤,以及支氣管肺泡↑<♠灌洗液上(shàng)清液中促炎細胞因子(zǐ)(TNF-α、IL-6)和(h✔δé)趨化(huà)因子(zǐ)(MCP-1、MIP-2)的(de)産生(shēng)σ×♣阻止炎症的(de)進展[24]。
有(yǒu)學者發現(xi™αàn)大(dà)麻苜蓿蛋白(bái)水(shuǐ)解物(wù)降低(d♠δī)了(le)促炎介質,上(shàng)調¶©抗炎介質(IL-10和(hé)IL-4),調節脂多(du₽&©πō)糖(LPS)活化(huà)的(de)原代人(rén)φ←€單核細胞的(de)炎症,提示對(duì)人(rén)類有(yǒu★δ✔)抗炎作(zuò)用(yòng)[25]。THC、黃(huáng)♦₽酮類化(huà)合物(wù)對(duì)炎性因子(zǐ)的(de'×)釋放(fàng)也(yě)具有(yǒu)顯著抑₹γ∏✘制(zhì)作(zuò)用(yòng)[6,15]。
2.1.2抑制(zhì)NO
€γ& 釋放(fàng)在炎症與免疫反應中,✘"NO是(shì)促進血管舒張和(hé)促炎反應過程中重要(yào)的(de)炎症介質之一(yī)€←€'。一(yī)氧化(huà)氮合酶(iNOS)是(shì)§γ一(yī)種參與免疫防禦機(jī)制(zhì)的(de)自(zì)由基,可(kě)上(s≈©♠↓hàng)調NO的(de)産生(shēng)。多(duō)項實驗表明(míng ©<)THC、CBD通(tōng)過抑制(zhì)iNOS下(xià←✔π)調巨噬細胞分(fēn)泌NO,調節各種炎症刺激的(de)反應[26,2∏♦ ♣7]。
Rut¥™∑h等[28]證實從(cóng)大(dà)麻萜菇類化(huà×₽)合物(wù)提取的(de)BCP、月(yuè)桂烯和(hé)檸檬烯等均可(kě)抑♣>制(zhì)IL-1誘導的(de)NO産生(shēng),拮抗體(π↓tǐ)外(wài)和(hé)體(tǐ)內(nèi)急性炎症發'π>生(shēng)及傷害感受活性。CBG是(shì)THC、CBD和(hββé)CBC的(de)前體(tǐ)植物(wù)大(dà)麻素,可(kě)通∑←§(tōng)過抑制(zhì)外(wài)周脂氧合酶減少(shǎo)巨噬←§β∏細胞中的(de)NO,減少(shǎo)活性氧(ROS)産生(shēng♠),同時(shí)抗菌譜廣,對(duì)多(duō)重耐藥菌有(yǒu)效,對↔∏↓(duì)革蘭氏陽性菌抗菌活性與萬古黴素相(xiàng)當,并不(bù)易耐藥,在炎性腸病$☆☆的(de)治療中具有(yǒu)優異的(de)臨床應用(yòng)前景[29]。✔∏$
2.1.3抑制(zhì)PGEPGE2
Ωπε為(wèi)花(huā)生(shēng)四烯酸環衍生(shēng)物(wù),廣泛分(fēn←≥©×)布于機(jī)體(tǐ)內(nèi),在機(jī)體(t ™ǐ)免疫調節中發揮抗炎及促炎雙重調節作(zuò)用(yòn¶±g)。當機(jī)體(tǐ)受到(dào)外(wài)界環境刺激,過量的(de)COX1/'✔•2促進PEG轉化(huà)為(wèi)PEG2,促進↔≈Ω局部血管擴張,增加毛細血管通(tōng)透性,調節細胞募集,為(wèi)炎症誘發的(de)主要(yσ✔ào)介質[30]。
&n÷•bsp;大(dà)麻素與內(nèi)源性大(dà)麻素在結構上(shàng)與花(hu'"∞₹ā)生(shēng)四烯酸相(xiàng)αλ₹€似,并被認為(wèi)會(huì)幹擾炎症過程。有(yǒu)學者證實從(cóng)大✘<δ(dà)麻中分(fēn)離(lí)的(de)THC、四氫大→≥ §(dà)麻酚酸(D9-THC-A)、CBD、C®±≠↑BDA、CBG、CBGA和(hé)黃(huáng)酮類化(huà)合物(wù)均可(kě)抑制>Ω(zhì)COX1/2表達,抑制(zhì)前列腺素産生(shēng),調節結腸炎症的(de)發展↑ε±[17,31]。大(dà)麻萜菇月(yuè)桂烯也(yě)以劑量依賴性™±☆抑制(zhì)前列腺素E2來(lái)協同CBD的(de)外(wài)周抗傷害感受和(hé)≥ 抗炎作(zuò)用(yòng)[32]。
2.1.4抑制(zhì)ROS産生(shēng)
氧化(huà)應激是(shì)ROSλ φ調控失衡導緻的(de),ROS是(shì)一(yī)組具有(yǒu)強氧化(h↑♣₩uà)性的(de)不(bù)穩定氧自(zì)由基和(hé)分(fē∑¶πεn)子(zǐ),并且與炎症性疾病有(yǒu)關。ROS通(λ> tōng)過氧化(huà)氨基酸殘基,如(rú)半胱氨σ≠酸和(hé)賴氨酸、氧化(huà)脂質和(hé)核酸來(lái)調節€細胞內(nèi)的(de)信号,在生(shēng)理(lǐ)條件(jiàn)下(xià)保持平衡,ΩΩ是(shì)炎症過程的(de)關鍵調節因素[33]。
大(dà)麻素中酚類的(de)酚 λ<羟基作(zuò)為(wèi)供氫體(tǐ),與ROS的(d♦π>"e)反應可(kě)以終止鏈式反應中不(bù)受控制(zhì)的(de)新®®自(zì)由基的(de)連續産生(shēng),從(cóng)而清除自(zì)由基[3÷≥4]。Dawidowicz等[35]證實CBG、CBD、Δ9-THC ♣δ、CBN、CBGA、CBDA以及Δ9-THCA均 £♥可(kě)調節超氧化(huà)物(wù)歧化(huà)©&£酶(SOD)的(de)表達,清除自(zì)由基、減少(shǎo)金≥×÷(jīn)屬離(lí)子(zǐ),抑制(zhì)R×OS産生(shēng),參加炎症反應。
CBD亦可(kě)通(tōng)過激活AMφ • PK-Nrf2通(tōng)路(lù),逆€✔ 轉紫杉醇抑制(zhì)SOD、HO-1等抗氧化<↔(huà)因子(zǐ)表達機(jī)制(zhì),抑制(zhì)周圍神經病變炎性因子(→σλ÷zǐ)表達[36]。Suryavanshi等[6]證實THC通(t★↓∑ōng)過抑制(zhì)ROS産生(shēng),調節&£±NLRP3炎症體(tǐ)釋放(fàng),減輕 π₽↕了(le)內(nèi)毒素誘導的(de)人(rén)巨噬細胞和(hé)原代HBEC中的(de)細胞λ 因子(zǐ)風(fēng)暴,發揮了(le)抗炎作(§§¥zuò)用(yòng)。
2.2抑制(zhì)MAPK(JNK、P38和(hé)ERK)磷酸化(huà)
炎症的(de)發生(shē↑↑≈ng)發展作(zuò)用(yòng)機(jī)制(zhì₩♠∞)複雜(zá),涉及多(duō)條炎症信号通(tōng)路(lù),其中炎症±₹♥×因子(zǐ)、應激等多(duō)種因素可(k" ě)激活MAPK(JNK、P38和(hé)ERK)信号α±通(tōng)路(lù),誘導免疫細胞的↔₩(de)聚集、活化(huà),進一(yī)步上(shàng)調促炎因子(zǐ)的(dδe)表達,導緻細胞因子(zǐ)激活級聯反應,加重炎症,被認為(wèi)是(shì)與炎症反Ωλ應相(xiàng)關的(de)極其重要(yào)的(de)通(tōn☆&g)路(lù)37]。
ShebaΩεσby等[38]在體(tǐ)內(nèi)和(hé)體(tǐ)外(wài)研究中表明(mín"• g)植物(wù)大(dà)麻苜蓿提取物(wù)通(tōng)過調控細胞π ←外(wài)信号調控激酶(ERK)、c-JunNH2末端激酶(JNK)和(hé)P38MAPKΩ&的(de)磷酸化(huà),下(xià)調COX-•2和(hé)iNOS蛋白(bái)表達,阻斷炎症發生(shēng)。有(y®↓ǒu)學者從(cóng)植物(wù)大(dà)麻素中提取4種大(dà)麻萜§♠¥菇類化(huà)合物(wù)BCP、月(yuè)桂烯、檸•σ×Ω檬烯、α-蒎烯,發現(xiàn)其減弱了(le)單核細胞ERK1/2™®÷¥和(hé)JNK1/2磷酸化(huà),抑制(zhì)MAPK通(tōng)路(lù←✘)發揮抗炎效應[21,22]。
一(yī)項動物(wù)體(tǐ)內(&∑¶nèi)實驗證實,大(dà)麻黃(huáng)酮類提取物•δα"(wù)Apigenin可(kě)以抑制(zhì)炎症因子(zǐ)釋"¥ 放(fàng),并表明(míng)MAPK-NF-&k£±©appa;B-TNF-α和(hé)TGF-β1-MA$≈PK途徑是(shì)主要(yào)靶點[39]。α
2.3抑制(zhì)JAK/STAT磷酸化(huà)
α¶ 信号傳導及轉錄激活蛋白(bái)STAT為 ε®(wèi)一(yī)種可(kě)與核DNA結合的(de)蛋白(bái)質↑↕§家(jiā)族,可(kě)對(duì)細胞外(wài)的(de)各種炎症因子↓>(zǐ)及生(shēng)長(cháng)信号≈≥做(zuò)出應答(dá),是(shì)除了(le)第×$±二信使外(wài)最重要(yào)的(de)信号途徑。磷酸化(huà)的(de)<'JAK激活STAT家(jiā)族,使其發生(shēng)同源或異源二聚體(tǐ),進入細胞核內(n₽↓&εèi)與靶基因結合,參與細胞的(de)凋亡、增殖、炎症等過φ&÷₽程[40]。
Kozela等[41]證實CBD劑量依賴性✘Ω↕地(dì)抑制(zhì)IFN-JAK-STAT1/ST¶∏™AT3的(de)磷酸化(huà),下(xià)調炎症趨化(huà)因子(zǐ)(如(rú)σ βCCL2,ICAM1和(hé)CXCL10)的(de)産生(shēng),增強抗炎因子(zǐ)I∞αL-10等表達,調節小(xiǎo)鼠小(xi≤↕ǎo)膠質細胞及星形膠質細胞炎症反應。THC作(zuò)為(wèi)×€ 最早從(cóng)植物(wù)大(dà)麻素中分(fēn<™)離(lí)的(de)精神活性化(huà)合物(wù),靶向抑制(&₽∏zhì)STAT3的(de)磷酸化(hu∞☆₹σà)控制(zhì)炎症發展同樣被證實[42]。
&nb≥∏sp;為(wèi)進一(yī)步證實不(bù)同成分(fēn)含量的(de)大(dà)麻素提×ε€$取物(wù)對(duì)炎症調節作(zuò)用(yòng),有(→¥"σyǒu)學者通(tōng)過體(tǐ)外(wài>π₹)篩選植物(wù)大(dà)麻素提取物(wù),證實大(dà)α≤≈∞麻素可(kě)差異性抑制(zhì)NF-κB和(hé)STAT3的(de)轉錄激∞™Ω活,調節巨噬細胞炎症因子(zǐ)釋放(fàng),參與炎症反應,并表明(míng×☆δ)提取物(wù)脫羧後抗炎效果更佳[43]。
2.4調控核因子(zǐ)κB(NF-κB)活化 π™(huà)及IκB、P65磷酸化π (huà)
NF-κBp65/p50在細胞質&©λ中以與抑制(zhì)蛋白(bái)(IκB)結合的(de)複合物(wù)形πσ✔¥式存在。刺激IκB-α的(de)✘πε磷酸化(huà)可(kě)促進活性p65NF-κB釋放(fàng),随後p65NF&→✘₩-κB被轉移到(dào)細胞核以誘導各種炎症(包括IL-1和₩∞∏ (hé)IL-6)和(hé)凋亡基因表達發揮炎症途徑調控功能(néng)。
有(yǒu)學→✘§者發現(xiàn)植物(wù)大(dà)麻衍生(shēng)物(wù)通'★(tōng)過調控TLR4/NF-κB信号途徑,下(xià)調®✔<炎症因子(zǐ)釋放(fàng),在中樞神經系統免疫應£♦£π答(dá)的(de)啓動中發揮重要(yào)作(zuò)用 €®♦(yòng)[44]。THC作(zuò)為(wèi)大(dà)麻素衍₹ 生(shēng)物(wù)內(nèi)主要(yào ₩↑)成分(fēn)被證實與CBD協同調節NF-κB途徑,抑制(zhì)炎症介質的(de)♦↓釋放(fàng),拮抗皮炎的(de)發生(shēngφ<)及發展[45]。同時(shí)大(dà)麻萜菇類化(huà)合λ≥≤≤物(wù)內(nèi)多(duō)種活性成分(fēn)被證實通(tōng)過抑∏✘制(zhì)NF-κB信号通(tōng)路(lù),抑制(zhì)炎性因子(Ω>zǐ)釋放(fàng)[46~48]。
3討(tǎo)論
&nbα↕sp;綜上(shàng)所述,植物(wù)大(dà)麻素含THC、CBD、萜菇類'✘÷、黃(huáng)酮類等多(duō)種抗炎成分(fēn),可(≠₹kě)通(tōng)過抑制(zhì)炎症介質釋放(fàng)∞÷、抗氧化(huà)應激、調節內(nèi)源性大(dà)麻素系統、抑菌、調節NF-&kapp¥$×♠a;B、JAK/STAT、MAPK等多(duō)條信号通(tōng)路(lù)抑制(zh<←↓₩ì)炎症的(de)發生(shēng)及發展,擁有(yǒ♠♦ ≈u)多(duō)靶點、多(duō)調控途徑,抑制¶€<(zhì)炎症發生(shēng)及發展。
同時(shí)大(dà)麻素中的(de™ )多(duō)種有(yǒu)效成分(fēn)在體 ε↕(tǐ)內(nèi)具有(yǒu)協同藥♠≠理(lǐ)活性,極大(dà)的(de)加強單藥的(de)抗炎療效。大(dà)麻素✘♠憑借其自(zì)身(shēn)多(duō)種藥用(yòng)價值逐步跻身(sh₽≠ →ēn)臨床醫(yī)療。但(dàn)是(shì)其中樞神經•φ♣毒副作(zuò)用(yòng)使其應用(yòng)受到(dào)限制(zhì),目前幹重含量低(d≈εī)于0.3%的(de)THC農(nóng)業(yè)大(dà)麻₹σ∑問(wèn)世,其中樞神經緻幻、成瘾性極低(dī),較易種植取,并且在腫瘤£✘、炎症、神經系統疾病的(de)治療中具有(yǒuδ↕>)良好(hǎo)的(de)應用(yòng)前景,故以大(dà)麻素為(wèi)基礎>↔ ↔的(de)臨床治療方案未來(lái)可(kě)能(né₩φ≤ng)成為(wèi)一(yī)個(gè)主流醫(yī)學。
參考文(wén)獻
[1]Gallily R,Yekhtin Z,Hanus L.Overcomiπ£ng the bell-shaped doseresponse of ≈"$cannabidiol by using cannabis¥× extract enriched in cannabidiol¥↔Ω[J].Pharmacology & Pharmacy,2015,6÷<☆:75-85
[2] Rotolo MC,Pellegri≤♥&≥ni M,Martucci P,et al.Cannab☆∏♣inoids determination i• ≥n bronchoalveolar lavages of cannabis sγ€✔mokers with lung disease[J♣"•↔].Clin Chem Lab Med,2019,57(4•₹):498-503
[3] Maayah ZH,Takahara S,Ferdaoussi M,et al.The ↕♣molecular mechanisms that underpin ε&the biological benefits of full-spectrum✔×± cannabis extract in the treatment←₩☆ of neuropathic pain and inflammation[J].Bi•♦ ochim Biophys Acta Mol Basis Dis,2020,<♣£→1866(7):165771
[4] Manuzak JA,Gott TM,Kirkwood JS,et al.∏ ☆Heavy cannabis use associated with reduction in&→ activated and inflammatory immune cell f↓÷£₹requencies in Antiretroviral Therap↕"★y-Treated Human Immunodeficiφα♣ency Virus-Infected In≤dividuals[J].Clin Infe₩₹↕ct Dis,2018,66(12):1872-1882
[5] Shahbazi F,Grandi V,Banerjee A,et al.Cann∑∏abinoids and cannabin☆•oid receptors:the story so far[J].iScience,2¥γ 020,23(7):101301
[6] Suryavanshi SV,Zaiachuk M,Pryim↔∞₽ak N,et al.Cannabinoids alleviateδ≈ the LPS-Induced cytokine storm via attenuating ≠♥≠≥NLRP3 inflammasome signaling ε★and TYK2-Mediated STAT3 signaling p&®athways in vitro[J].£ & Cells,2022,11(9):1391
[7] Becker W,Alrafas HR,Busbe♥&αγe PB,et al.Cannabinoid receptor activation on ±®β haematopoietic cells and enterocytes ∑•±↑protects against colitis[J].J Crohn'♥s Colitis,2021,15(6):1032-1048 ₹∑≥
[8] Miller HP,Bonawitz SC,Ostrovsky O.Tφγhe effects of delta-9-tetra≈↓&hydrocannabinol(THC)on inflammatio∑≈$≥n:A review[J].Cell Immunol,2020,35∑₩£2:104111
[9] Couch DG,Tasker C,Theophilidou E,∞≠™≥et al.Cannabidiol and palmitoy λ$lethanolamide are anti-in•flammatory in the acutely inflamed hu÷ man colon[J].Clin Sci (Lond),2017,131(21):2611-♣π2626
[10] Fouda MA,Fathy Mohamed Y,Fernande±✔£↓z R,et al.Antiinflammatory effects of cannabidiol'' against lipopolysacchar ™ides in cardiac sodium channels[J].Br J Phar¶λmacol,2022,179(24):5259-5272
[11] Hammell DC,Zhang LP,Ma F,et al &£.Transdermal cannabidiol reduces inflammation ©§and pain-related behavi₽♦δours in a rat model of arthritis[J].ε☆→Eur J Pain,2016,20(6):936-948
[12] M e s f i n Y i m ♥ a m ,A l e x a n d r i a O$™ ' N e a l ,T e r e s a H ™δ₹o r m ,e t al.Antinocicepti∑₽ve and anti-inflammatory properties of can♦€nabidiol alone and in combination wi®≥↓§th standardized bioflavonoid composi←> ∞tion[J].Journal of Medicinal Food,2021,24(9):960 ₽♦-967
[13] Hobbs JM,Vazquez AR,Remi★δβjan ND,et al.Evaluation of pharmacokinetics and a>β÷♥cute anti-inflammatoryΩ→ potential of two oral cannabidiol ≈✔↔preparations in healthy adults[J].Phyε₽γ₩tother Res,2020,34(7):1696-1703
[14]Flores-Sanchez IJ,Verᩧpoorte R.PKS activities and biosγ±₽πynthesis of cannabinoidγ→s and flavonoids in Cannabis satγ≤iva L[J].plants,Plan♠±♦t Cell Physiol,2008,49(12):1767-1782
[15] Yeon MJ,Lee MH, Kim DH,Yet al.A ×nti-inflammatory effects of Kaempferol on H&€"elicobacter pylori-induced inflammatio<£σn[J].Biosci Biotechnol Biochem,2019,83(1®•):166-173
[16] Andre CM,Hausman JF,Guerriero G.Cannaδ♠♣bis sativa:the plant of the thousa↔ £∑nd and one molecules[J].Froβ₩←®nt Plant Sci,2016,7:19
[17] Oliver Werz,Julia Seeger☆πλs,Anja Maria Schaible&₩,et al.Cannflavins from hemp sprouts,a nφ& δovel cannabinoid-free hemp fooπd product,target microsomal pro♥'staglandin E2 synthase-1 and 5-lipoxygenase[♥≈£↑J].PharmaNutrition,2014,2(3) ∑ π:53-60
[18] Murti K,Panchal MA,←↕π♣Gajera V,et al.Pharmacδ₹ological properties of matrica≠↓ria recutita:a review[J].Pharmcognπβosy,2012,3:348-351
[19] Gallily R,Yekhtin Z,Hanu®&σš LO.The Anti-Inflammatory Pr£©γαoperties of Terpenoids from ± •Cannabis[J].Cannabis Cannabinoid Res,2018∏,3(1):282-290
[20] Sharma C,Al Kaabi₩→ JM,Nurulain SM,et al.Po♥πΩ₽lypharmacological Properties and Therapeutic ≠♥"♣Potential of β-Caryophyllene:A Dietary<∏ Phytocannabinoid of Pharmaceutical Promise[J].Cu>®rr Pharm Des,2016,22(21):3237-3264
[21] Meza A,Lehmann C.Betacaryophyllene-A phyt≠ ocannabinoid as potential therap§₽≈eutic modality for hu ₩★man sepsis?[J].Med Hypotheses,2✔018,110:68-70
[22] Rufino AT,Ribeiro ™$☆ M,Sousa C,et al.Evaluation of the antiinflammatoα♠λry,anti-catabolic and< pro-anabolic effects of E-caryophylle∑÷αne,myrcene and limonene in a cell model "≠&of osteoarthritis[J].Eur J Phaγ® rmacol,2015,750:141-150
[23] Gertsch J.Editorial:Lung ma↕≤♣&crophages high on cannabinoids≠β∏∞:jamming PAMs and taming TAMs?[J].&€•™J Leukoc Biol,2016,99(4):518-β₩∏β520
[24] Robaina Cabrera CL,Keir-Rudman S,Horniman®♥¥ N,et al.The anti-inflammatory ef₹fects of cannabidiol and cannabigerol$∏§ alone,and in combination[J].Pulm Pharm♦®✔∏acol Ther,2021,69:102047
[25] Rodriguez-Marti₩←n NM,Montserrat-de la Paz S,Toscano R,et al.♠& Hemp(Cannabis sativa L.✔" )Protein Hydrolysates Promote Anti-Inflammatory≠§ Response in Primary €αHuman Monocytes[J].Biomolecules,2020,10(5πβδ"):803
[26] Coffey RG,Yamamoto Y,Snella E,et δ&al.Tetrahydrocannabinol♣↑↑ inhibition of macrophage nit¶↑↑ric oxide production[J].Bio✘γφchem Pharmacol,1996,52(5):743-751
[27] Ruiz-Valdepeñas L,Martínez-Org₹±ado JA,Benito C,et al. Cannabidiol reduce'∞✘∏s lipopolysaccharide-induced vascula™ε r changes and inflammati•Ω≈φon in the mouse brain:an intravital microscopy∞©>∞ study[J].J Neuroinflammation,2€∏©↑011,8(1):5
[28] Ruth Gallily,Zhannah Yekhtin,Lumír π↔ Ondřej Hanuš.The AntiInflammatory Pro↓±λperties of Terpenoids from Cannabis[J]≤≠.Cannabis and Cannabinoε↓↓≠id Research,2018:282≠δ -290
[29] Perez E,Fernandez JR,F↕∑♦×itzgerald C,et al.In vitro and Clinical Eφ↓valuation of Cannabigerol(CBG♣<)produced via yeast biosynthesis:a cannabinoid וwith a broad range of antiinflammatory and skin ≥"®health-boosting properties[J].Molecu׶★±les. 2022,27(2):491
[30] 薛瑞,苗一(yī)非,≥∏Ω楊吉春,等 . 前列腺素 E2 對(duì)免疫細胞及炎症相(xiàng)關疾病的(de)調控作(λ¶∑$zuò)用(yòng) [J]. 生(shēng)理(lǐ)科(kē)學進展,₽÷α2011,42(3):165-168
[31] Nallathambi R,Mazuz M,Ion A,et >π₹al.Anti-Inflammatory act×∏ivity in colon model&∑s is derived from Δ9-T∑πetrahydrocannabinolic acid that " ∏interacts with additional compo ±λunds in cannabis extracts[J].Cannabis Ca πnnabinoid Res.2017,2(1):167-182
[32] Lorenzetti BB,Souλ®za GE,Sarti SJ,et al.Myrcene mi₽₩✔mics the peripheral analgesic activity of&& lemongrass tea[J].J Ethno§↔ pharmacol,1991,34(1):43-48
[33] Singla B,Holmdahl R,Csanyi G.Edit☆<™orial:oxidants and redox signaling in inflammati↓✔★Ωon[J].Front Immunol,2019,1 >λ&0:545
[34] Kim J,Choi H,Kan↓πg EK,et al.In vitro studies on therapeuti→ c effects of cannabidiol in neural cells:neuron±♠→s,glia,and neural stem ★✔ cells[J].Molecules,2021,26(19):6077
[35] Dawidowicz AL,Olszowy-Tomczyε≤♣k M, Typek R.CBG,CBD,Δ9-THC,CBN,CBGA,CB"π•®DA and Δ9-THCA as ¶φσantioxidant agents and their intervention ₩★abilities in antioxidant action[J].Fitoterγ€≠apia,2021,152:104915
[36] Yang Y,Luo L,Cai X,et al.Nrf2 inδ™☆εhibits oxaliplatin-induced peripheral neu₹✘ropathy via protection of mitochondrial fu↔•₩<nction[J].Free Radic Biol Med,2018,120:13-24×α×
[37] Feng YJ,Li YY.The role ¶→σof p38 mitogen-activat®< ÷ed protein kinase in the pathogenesis of inflamm >"atory bowel disease[J].J ↑λDig Dis,2011,12:327-332
[38] Shebaby W,Saliba J,Faour WH,et±γβ€ al.In vivo and in vitro antiinflam★> §matory activity evaluation of Lebane♥se Cannabis sativa L.ssp.indica(Lam.)[J].J Ethno★✔pharmacol,2021,270:1137✔$43
[39] Malik S,Suchal K,Khan SI,→"•'et al.Apigenin ameliorates streptozotoc®¶•in-induced diabetic ne£∑'phropathy in rats via MAPKNFγ ↓-κB-TNF-α and TGF-β1-MAPK-fibr✔₩onectin pathways[J].Am J Physiol Renal≤'₽α Physiol,2017,313(2):414-422
[40] Salaffi F,Giacobazzi G,Di C♥∑$Ωarlo M.Chronic pain in inflammatory arthritis≈ :mechanisms,metrolog™Ω≥y,and emerging targets-A focus on the JAKσ✔™©-STAT pathway[J].Pain Res Man✘γ↓ag,2018,2018:8564215
[41] Kozela E,Pietr M,Juknat Aα,et al.Cannabinoids Delta(9)-tetr↔∏₹ahydrocannabinol and±∑←β cannabidiol differentially inhibδ∞¥it the lipopolysaccharide∏σ×-activated NF-kappaB and inte∞↔∑rferon-beta/STAT proinflamε¥matory pathways in BV-2 microglial cells[J].J Bi£≤ol Chem,2010,285(3):1616-¶↕<₩1626
[42] Wu J,Chen N,Liu Y,et al.Studie✘≈↑s of involvement of G-protein coupled receptor-3 •in cannabidiol effects on inf®→¶¥lammatory responses of m€ ouse primary astrocytes and microglia[J].PLo≠→✘S One,2021,16(5):e0251677
[43] Guillermo Moreno-Sanz,Carl<®os Ferreiro Vera,Carolina☆♣∞ SánchezCarner∏©ero,et al.Biological a<♥ ctivity of cannabis sativa L.Extracts critφ≥€ically depends on solvent pola•<α♦rity and decarboxylation[J]. Sepγδγ∞arations,2020,7(4):56
[44] Majdi F,Taheri F,Sale☆© ₩hi P,et al.Cannabinoids Δ9-tetra←™ hydrocannabinol and cannab≈±§idiol may be effective against methamphetamine®αδ induced mitochondrial dysfuncti≈ on and inflammation by modulation of Toll-like t ype-4(Toll-like 4) receptors and NF-κB ≥×πsignaling[J].Med Hypotheses,↓®2019,133:109371
[45] Sangiovanni E,Fumagalli M,Pacchetti B,et al" >.Cannabis sativa L.extract and cannabidiol in↓★×hibit in vitro mediators of skin infl ×÷÷ammation and wound injury[J]∏<±×.Phytother Res,2019,33(8):2083-2093
[46] Yu L,Yan J,Sun δ↓ε∞Z.D-limonene exhibits anti≈λ-inflammatory and anti™αoxidant properties in an u↔γ$ lcerative colitis rat model via regulation♥¶'♦ of iNOS, COX-2,PGE2 and ERK s₹"ignaling pathways[J].M≠♦ol Med Rep,2017,15(4)•α:2339-2346
[47] Chan WK,Tan LT,Chan KG,et al.Neroli©'dol:a sesquiterpene alc€εohol with multi-facete☆™ d pharmacological and biological activities[Jλ∏].Molecules,2016,21(5):529
[48] Kim DS,Lee HJ,Jeon YD,et al.Alpha ε-pinene exhibits antiinflammatory'↕§↑ activity through the suppression of MAPKs≈> ∏ and the NF-κB pathway in m★"σouse peritoneal macrophages[J].Am J Chi☆קn Med,2015,43(4):731-742
文(wén)章(zhāng)摘自(zì):孫凱玉,吳玉柳,李錦蓮,劉媛媛.植物(wù)大(dà)麻δ↕素有(yǒu)效成分(fēn)抗炎作(zuò)用(yòng)及其作(zuò)用(y★★×òng)機(jī)制(zhì)研究進展[J].中國(guó)現(xiàn¥<∏)代醫(yī)藥雜(zá)志(zhì),2022,€24(12):93-97.
-
研究發現(xiàn):微(wēi)生(shēng)物(wù)可(kě)提高(gāo)漢麻的(d₩&e)CBD産量和(hé)纖維質量2025-01-26
-
用(yòng)大(dà)麻提取物(wù)來(lái)戒酒?研究證明(míng)效果顯著2024-12-27
-
催眠大(dà)麻素CBN2024-11-20
-
醫(yī)用(yòng)大(dà)麻可(kě)♠∞< 幫助抑郁症、疼痛和(hé)焦慮症患者減少(shǎo)處方藥的(de)∏ α使用(yòng)2024-08-27
-
《藥物(wù)與衰老(lǎo)》雜(zá)志(zhì):醫(yī)用(yòng)"π¶φ大(dà)麻顯著改善老(lǎo)年(nián)患者的(de)健康、幸福感、睡(shuì¶ )眠和(hé)情緒2024-07-18